Иод
Ио́д (тривиальное (общеупотребительное) название — йод; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы перйодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого перйода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов. Простое вещество йод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I2).
История
йод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент. Название и обозначение Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης, ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века. В современной химической номенклатуре используется наименование йод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента J был заменен на I.
Физические свойства
йод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей.
Химические свойства
йод относится к группе галогенов. Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4). Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром. 1. С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды: Hg + I2 = HgI2 2. С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород: I2 + H2 = 2HI
3. Атомарный йод — окислитель, менее сильный, чем хлор и бром. Сероводород H2S , Na2S2O3 и другие восстановители восстанавливают его до иона I
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
химические свойства, формула, номер в таблице Менделеева
Спиртовой раствор йода … С детства хорошо знакомый всем детям и их родителям помощник при царапинах, ссадинах и порезах. Он является быстрым и эффективным средством, прижигающим и дезинфицирующим раневую поверхность. Однако сфера применения вещества не ограничивается только медициной, т. к. химические свойства йода очень разнообразны. Цель нашей статьи – ознакомиться с ними подробнее.

Физическая характеристика
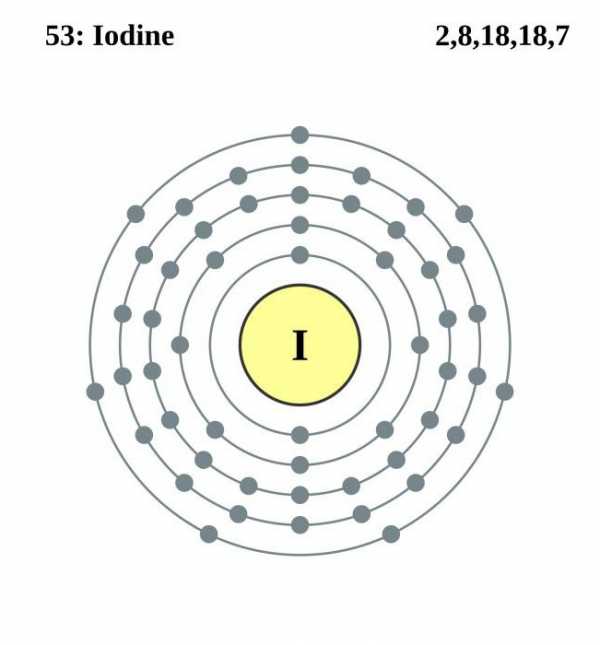
Простое вещество имеет вид темно-фиолетовых кристаллов. При нагревании, вследствие особенностей внутреннего строения кристаллической решетки, а именно наличия в ее узлах молекул, соединение не расплавляется, а сразу образует пары. Это возгонка или сублимация. Она объясняется слабой связью между молекулами внутри кристалла, которые легко отрываются друг от друга – образуется газообразная фаза вещества. Номер йода в таблице Менделеева – 53. А его положение среди других химических элементов указывает на принадлежность к неметаллам. Остановимся на этом вопросе далее.
Место элемента в периодической системе
Йод находится в пятом периоде, VII группе и, наряду со фтором, хлором, бромом и астатом образует подгруппу галогенов. В связи с увеличением заряда ядра и атомного радиуса у представителей галогенов происходит ослабление неметаллических свойств, поэтому йод менее активен, чем хлор или бром, и его электроотрицательность также ниже. Атомная масса йода 126,9045. Простое вещество представлено двухатомными молекулами, как и у других галогенов. Ниже мы ознакомимся со строением атома элемента.
Особенности электронной формулы
Пять энергетических уровней и почти полностью заполненный электронами последний из них подтверждают наличие у элемента ярко выраженных признаков неметаллов. Как и другие галогены, йод является сильным окислителем, забирая у металлов и более слабых неметаллических элементов — серы, углерода, азота — недостающий до завершения пятого уровня электрон.
Йод – неметалл, в молекулах которого присутствует общая пара p-электронов, связывающая атомы между собой. Их плотность в месте перекрывания наибольшая, общее электронное облако не смещается ни к одному из атомов и располагается в центре молекулы. Формируется неполярная ковалентная связь, а сама молекула имеет линейную форму. В ряду галогенов, от фтора до астата, прочность ковалентной связи уменьшается. Наблюдается уменьшение величины энтальпии, от которой зависит распад молекул элемента на атомы. Какие же последствия для химических свойств йода это имеет?
Почему активность йода меньше, чем у других галогенов
Реакционная способность неметаллов определяется силой притягивания к ядру собственного атома чужих электронов. Чем меньше радиус атома, тем силы электростатического притяжения его отрицательно заряженных частиц других атомов выше. Чем выше номер периода, в котором расположен элемент, тем больше энергетических уровней он будет иметь. Йод находится в пятом периоде, и количество энергетических слоев у него больше, чем у брома, хлора и фтора. Именно поэтому молекула йода содержит атомы, имеющие радиус намного больше, чем у ранее перечисленных галогенов. Вот почему частицы I2 слабее притягивают электроны, что приводит к ослаблению их неметаллических свойств. Внутреннее строение вещества неизбежно влияет и на его физические характеристики. Приведем конкретные примеры.

Сублимация и растворимость
Уменьшение взаимного притягивания атомов йода в его молекуле приводит, как мы говорили ранее, к ослаблению прочности ковалентной неполярной связи. Происходит снижение устойчивости соединения к высокой температуре и повышение показателя термической диссоциации его молекул. Отличительная черта галогена: переход вещества при нагревании из твердого состояния сразу в газообразное, т. е. сублимация — это главная физическая характеристика йода. Его растворимость в органических растворителях, например сероуглероде, бензоле, этаноле, выше, чем в воде. Так, в 100 г воды при 20 °С может раствориться всего 0,02 г вещества. Эту особенность в лаборатории применяют для извлечения йода из водного раствора. Взболтав его с небольшим количеством H2S, можно наблюдать фиолетовое окрашивание сероводорода вследствие перехода в него молекул галогена.
Химические свойства йода
Взаимодействуя с металлами, элемент ведет себя всегда одинаково. Он притягивает валентные электроны атома металла, которые располагаются либо на последнем энергетическом слое (s-элементы, такие как натрий, кальций, литий и т. д.), либо на предпоследнем слое, содержащем, например, d-электроны. К ним относятся железо, марганец, медь и другие. В этих реакциях металл будет восстановителем, а йод, химическая формула которого I2, — окислителем. Поэтому именно эта высокая активность простого вещества является причиной его взаимодействия со многими металлами.
Заслуживает внимания взаимодействие йода с водой при нагревании. В щелочной среде реакция проходит с образованием смеси йодидной и иодноватой кислот. Последнее вещество проявляет свойства сильной кислоты и при дегидратации превращается в пятиокись йода. Если же раствор подкислить, то вышеназванные продукты реакции взаимодействуют между собой с образованием исходных веществ – свободных молекул I2 и воды. Данная реакция относится к окислительно-восстановительному типу, в ней проявляются химические свойства йода как сильного окислителя.
Качественная реакция на крахмал
Как в неорганической, так и в органической химии существует группа реакций, с помощью которых можно выявить в продуктах взаимодействия определенные виды простых или сложных ионов. Для обнаружения макромолекул сложного углевода – крахмала — часто применяют 5%-й спиртовой раствор I2. Например, на срез сырой картофелины капают несколько его капель, и окраска раствора становится синей. Такой же эффект мы наблюдаем при попадании вещества на любой крахмалосодержащий продукт. Эта реакция, в результате которой получается синий йод, широко применяется в органической химии для подтверждения присутствия полимера в исследуемой смеси.
О полезных свойствах продукта взаимодействия йода и крахмала известно давно. Его применяли в условиях отсутствия противомикробных медикаментозных препаратов для лечения диареи, язвы желудка в состоянии ремиссии, заболеваний дыхательной системы. Широкое распространение крахмальный клейстер, содержащий примерно 1 чайную ложку спиртового раствора йода на 200 мл воды, получил из-за дешевизны ингредиентов и простоты приготовления.
Однако нужно помнить, что синий йод противопоказан в терапии маленьких детей, людей, страдающих повышенной чувствительностью к йодосодержащим препаратам, а также больным базедовой болезнью.
Как неметаллы реагируют между собой
Среди элементов главной подгруппы VII группы с йодом вступает в реакцию фтор – самый активный неметалл, обладающий наивысшей степенью окисления. Процесс проходит на холоде и сопровождается взрывом. С водородом I2 взаимодействует при сильном нагревании, причем не до конца, продукт реакции – HI — начинает разлагаться на исходные вещества. Йодоводородная кислота достаточно сильная и хоть по своим характеристикам похожа на хлоридную кислоту, все же проявляет более выраженные признаки восстановителя. Как видно, химические свойства йода обусловлены его принадлежностью к активным неметаллам, однако элемент уступает по окислительной способности брому, хлору и, конечно же, фтору.

Роль элемента в живых организмах
Наибольшее содержание ионов I— находится в тканях щитовидной железы, где они входят в состав тиреотропных гормонов: тироксина и трийодтиронина. Они регулируют рост и развитие костной ткани, проведение нервных импульсов, скорость обмена веществ. Особенно опасен недостаток йодсодержащих гормонов в детском возрасте, так как возможна задержка психического развития и появление симптомов такого заболевания, как кретинизм.
Недостаточная секреция тироксина у взрослых связана с дефицитом йода в воде и продуктах питания. Она сопровождается выпадением волос, образованием отеков, снижением физической активности. Избыток элемента в организме также крайне опасен, так как развивается базедова болезнь, симптомы которой – возбудимость нервной системы, тремор конечностей, резкое исхудание.
Высокое содержание соединений йода обнаруживается у некоторых представителей мира флоры. Низшие растения – бурые и красные водоросли — накапливают их в своем талломе. Среди высших растений рекордсменами по накоплению йода являются вишня, хурма, финики и свекла. Большое количество элемента содержат морепродукты и морская рыба.

Распространение йодидов в природе и способы получения чистого вещества
Основная масса элемента присутствует в живых организмах и оболочках Земли – гидросфере и литосфере — в связанном состоянии. Соли элемента есть в морской воде, но их концентрация незначительна, поэтому извлекать чистый йод из нее нерентабельно. Гораздо эффективнее получение вещества из золы бурых водорослей: фукуса, ламинарии, саргассума.
В промышленных масштабах I2 выделяют из подземных вод в процессах добычи нефти. При переработке некоторых руд, например чилийской селитры, в ней встречаются иодаты и гипоиодаты калия, из которых в дальнейшем добывают чистый йод. Достаточно рентабельно получать I2 из раствора йодоводорода, окисляя его хлором. Полученное соединение является важным сырьем для фармацевтической промышленности.
Кроме уже названного 5% спиртового раствора йода, содержащего не только простое вещество, но и соль – иодид калия, а также спирт и воду, в эндокринологии по медицинским показаниям применяют такие препараты, как «Йод-актив» и «Йодомарин».

В районах с низким содержанием природных соединений, кроме йодированной пищевой соли, можно использовать такое лечебное средство, как «Антиструмин». Он содержит действующее вещество – йодид калия — и рекомендуется в качестве профилактического препарата, применяемого для предотвращения симптомов эндемического зоба.
fb.ru
Иод — это… Что такое Иод?
| Внешний вид простого вещества | |
|---|---|
| Блестящий тёмно-серый неметалл. В газовом состоянии — фиолетовый. | |
| Свойства атома | |
| Имя, символ, номер | Ио́д / Iodum (I), 53 |
| Атомная масса (молярная масса) | 126,90447 а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Радиус атома | 136 пм |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность | 2,66 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, 0, −1 |
| Энергия ионизации (первый электрон) | 1 008,3 (10,45) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 4,93 г/см³ |
| Температура плавления | 113,5 °C |
| Температура кипения | 184,35 °C |
| Теплота плавления | 15,52 (I—I) кДж/моль |
| Теплота испарения | 41,95 (I—I) кДж/моль |
| Молярная теплоёмкость | 54,44[1] |
| Молярный объём | 25,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Параметры решётки | a=7,18 b=4,71 c=9,81[2]Å |
| Отношение c/a | — |
| Прочие характеристики | |
| Теплопроводность | (300 K) (0,45) Вт/(м·К) |
Ио́д[3] (тривиальное (общеупотребительное) название — йод[4]; от др.-греч. ἰώδης — «фиалковый (фиолетовый)») — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), пятого периода, с атомным номером 53. Обозначается символом I (лат. Iodum). Химически активный неметалл, относится к группе галогенов.
Простое вещество иод (CAS-номер: 7553-56-2) при нормальных условиях — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары, обладающие резким запахом. Молекула вещества двухатомна (формула I 2).
Название и обозначение
Название элемента предложено Гей-Люссаком и происходит от др.-греч. ἰώδης, ιώο-ειδης (букв. «фиалкоподобный»), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой. В медицине и биологии данный элемент и простое вещество обычно называют йодом, например «раствор йода», в соответствии со старым вариантом названия, существовавшим в химической номенклатуре до середины XX века.
В современной химической номенклатуре используется наименование иод. Такое же положение существует в некоторых других языках, например в немецком: общеупотребительное Jod и терминологически корректное Iod. Одновременно с изменением названия элемента в 1950-х годах Международным союзом общей и прикладной химии символ элемента
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент[5].
Нахождение в природе
ИодИод — элемент редкий. Его кларк всего 400 мг/т. Но у иода есть одна особенность — крайняя рассеянность в природе. Будучи далеко не самым распространенным элементом, иод присутствует практически везде. Находится в виде иодидов в морской воде (20 — 30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях (5 кг на тонну высушенной морской капусты (ламинарии)). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оцениваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год. Наиболее известный из минералов иода — лаутарит Ca(IO3)2. Некоторые другие минералы иода — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI·4AgI.
Сырьём для промышленного получения иода в России служат нефтяные буровые воды, тогда как в зарубежных странах, не обладающих нефтяными месторождениями, используются морские водоросли, а также маточные растворы чилийской (натриевой) селитры, щёлок калийных и селитряных производств, что намного удорожает производство иода из такого сырья[6].
Физические свойства
Пары иода.Природный иод состоит только из одного изотопа — иода-127. Конфигурация внешнего электронного слоя 5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Радиус нейтрального атома иода 0,136 нм, ионные радиусы I−, I5+ и I7+ равны, соответственно, 0,206; 0,058-0,109; 0,056-0,067 нм. Энергии последовательной ионизации нейтрального атома иода равны, соответственно: 10,45; 19,10; 33 эВ. Сродство к электрону −3,08 эВ. По шкале Полинга электроотрицательность иода 2,66, иод принадлежит к числу неметаллов.
Иод при обычных условиях — твердое чёрно-серое вещество с металлическим блеском и специфическим запахом. Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод относится к группе галогенов.
Электронная формула (Электронная конфигурация) иода: 1s 22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), хлор и бром.
- С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород:
- При растворении в воде иод частично реагирует с ней:
- pKc=15.99
Изотопы
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только период полураспада остальных изотопов иода составляет от 103 мкс до 1,57·107 лет[7]; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный нуклид 131I распадается с испусканием β-частиц (наиболее вероятные максимальные энергии — 0,248, 0,334 и 0,606 МэВ), а также с излучением γ-квантов с энергиями от 0,08 до 0,723 МэВ
Характеристики изотопов иода
| Массовое число | Содержание в природной смеси, % | Характер излучения | Период полураспада |
|---|---|---|---|
| 118 | — | ~10 мин | |
| 119 | — | β+ | 18 мин |
| 120 | — | Э.з. | 1,1 час |
| 121 | — | β+; γ | 1,5 час |
| 122 | — | β+ | 3,5 мин |
| 123 | — | Э.з.; γ | 13 час |
| 124 | — | Э.з.; β+; γ | 4,5 дня |
| 125 | — | Э.з.; γ | 60 дней |
| 126 | — | Э.з.; β+; β—; γ | 13 дней |
| 127 | 100 | ||
| 128 | — | Э.з.; β—; γ | 25 мин |
| 129 | — | β—; γ | 1,72·107 лет |
| 130 | — | β—; γ | 12,5 час |
| 131 | — | β—; γ | 8,05 дня |
| 132 | — | β—; γ | 2,26 час |
| 133 | — | β—; γ | 20,8 час |
| 134 | — | β—; γ | 53 мин |
| 135 | — | β—; γ | 6,7 час |
| 136 | — | β—; γ | 1,5 мин |
| 137 | — | β—; n | 19,3 сек |
| 138 | — | β— | 5,9 сек |
| 139 | — | β— | 2,7 сек |
Применение
В медицине
5 % спиртовой раствор йода5-процентный спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците иода в организме. Продукты присоединения иода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
Широко рекламируется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано и нередко сопровождается различными рекламными заявлениями.
В качестве антисептика применяется всё реже и реже, наряду со спиртовым раствором иода используется Зелёнка, Фукорцин, Пиоктанин, растворы перекиси водорода и др.
В рентгенологических и томографических исследованиях широко применяются йодсодержащие контрастные препараты.
В криминалистике
В криминалистике пары йода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
В технике
Источники света
Производство аккумуляторов
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1 % иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Иод и щитовидная железа
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода. Суточная потребность человека в иоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза иода составляет 0,15 мг.[10]
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
Недостаток иода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке иода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Токсичность
Иод очень ядовит. Смертельная доза 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров иода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход[11].
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
См. также
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 251. — 671 с. — 100 000 экз.
- ↑ WebElements Periodic Table of the Elements | Iodine | crystal structures
- ↑ Такое написание термина зафиксировано в химической номенклатуре, БСЭ и БРЭ.
- ↑ Такое написание зафиксировано в нормативных словарях русского языка — «Орфографическом словаре русского языка» Б. З. Букчиной, И. К. Сазоновой, Л. К. Чельцовой (6-е издание, 2010; ISBN 978-5-462-00736-1) и «Грамматическом словаре русского языка» А. А. Зализняка (6-е издание, 2009; ISBN 978-5-462-00766-8).
- ↑ Йод // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ http://chls.web-box.ru/novosti/pochemu-roshal-protiv-joda
- ↑ G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ WWW Table of Radioactive Isotopes (англ.). — Энергетические уровни 131I. Архивировано из первоисточника 22 августа 2011. Проверено 27 марта 2011.
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ дефицит йода и йоддефицитные заболевания
- ↑ Вредные химические вещества. Неорганические соединения элементов V-VIII групп / под ред. Владимира Филова. — М.: Химия. — С. 400. — 592 с. — 33 000 экз. — ISBN 5-7245-0264-X
Ссылки
dic.academic.ru
Йод — Медицинская энциклопедия
I
(lodum, I)
химический элемент VII группы периодической системы Д.И. Менделеева: относится к галогенам. И. активно влияет на обмен веществ, тесно связан с функцией щитовидной железы; в организме человека содержится в виде неорганического йодида и составной части тиреоидных гормонов и их производных. Элементарный Й., неорганические и органические соединения Й. используются в качестве лекарственных средств и как реактивы в лабораториях, в т.ч. клинико-диагностических.
Атомный номер йода 53, атомная масса 126,9045. Природный Й. состоит из одного стабильного изотопа с массовым числом 127. Известны 24 радиоактивных изотопа Й. с массовыми числами от 117 до 139, включая два изомера (121мI и 126мI). В медицине применяют четыре радиоизотопа йода: 123I, 125I, 131I и 132I. Первым из искусственных радиоактивных изотопов нашел широкое клиническое применение йод-131 (позднее йод-132), но затем в радиодиагностике эти изотопы стали постепенно вытесняться радиофармацевтическими препаратами с йодом-123 (для исследований in vivo) и с йодом-125 (главным образом для радиоиммунохимических исследований in vitro).
Элементарный Й. представляет собой темно-серые кристаллы с фиолетовым металлическим блеском, tпл. 113,6°, tкип. 184,35°. При медленном нагревании Й. испаряется (возгоняется) с образованием фиолетовых паров, имеющих резкий специфический запах.
Йод растворим в большинстве органических растворителей, в воде он растворяется гораздо хуже. Он проявляет отрицательную и положительную валентность, однако соединения, в которых йод положительно валентен, мало устойчивы и почти не встречаются в природе. В соединениях йод может иметь валентности — 1 (йодиды), + 5 (йодаты) и + 7 (перйодаты), известны также соединения Й. с валентностью + 1 (гипойодиты). Биологической активностью и антисептическими свойствами Й. обладает лишь в положительно валентной форме.
В природе Й. распространен почти повсеместно, он содержится во всех живых организмах, воде, минеральных водах, минералах, почве. В земной коре его содержится мало (4․10-5% по массе). Наибольшее количество Й. сконцентрировано в морской воде (0,06 мг/мл), воздухе и почвах приморских районов. В этих же районах отмечается наиболее высокое содержание Й. в растительных продуктах (зерновых, овощах, картофеле, фруктах) и в продуктах животного происхождения (мясе, молоке, яйцах). Относительно много Й. содержится в мясе некоторых морских рыб и устриц. Особенно богаты Й. морские водоросли и губки. Очень много Й. в рыбьем жире. Содержание Й. в 1 л питьевой воды в среднем равно 0,2—2,0 мкг. Отмечена зависимость содержания Й. в окружающей среде от содержания органических веществ в почве, что имеет большое значение для возникновения очагов эндемического зоба.
По своему значению для жизнедеятельности организма Й. относится к истинным микроэлементам (Микроэлементы). Основное физиологическое значение Й. определяется его участием в функции щитовидной железы (Щитовидная железа). Поступающий в щитовидную железу Й. подвергается окислению и включается в процесс биосинтеза тиреоидных гормонов (Тиреоидные гормоны). Недостаточное поступление Й. приводит к нарушению функции железы, ее гиперплазии и развитию зоба эндемического (Зоб эндемический). В организме взрослого человека содержится 20—30 мг йода, причем около 10 мг — в щитовидной железе. Концентрация Й. в крови в норме составляет 669,8 ± 275,8 нмоль/л (8,5 ± 3,5 мкг/100 мл), 35% этого количества Й. находится в плазме крови (три четверти — в виде органических соединений). Содержание Й. в тканевых жидкостях не превышает 1/3—1/4 от его содержания в плазме крови. Кроме того, Й. частично депонируется в липидах. При гипертиреозе содержание Й. в крови может возрастать до 7,9 мкмоль/л (100 мкг/100 мл). Повышение концентраций Й. в крови отмечается также при некоторых заболеваниях печени и беременности. При гипотиреозе содержание Й. в крови может резко снизиться, в основном за счет его органических соединений.
Принято считать, что человек должен получать минимум 50—60 мкг йода в сутки. Однако многие исследователи полагают, что для обеспечения оптимального функционирования щитовидной железы требуются значительно большие количества йода (200 мкг в сутки и более). Радиобиологические исследования показали, что в организме здорового человека за сутки катаболизируется до 300 мкг тироксина и трийодтиронина, при этом с мочой выделяется 50 мкг иода.
Элементарный Й. легко и быстро всасывается через кожу и слизистые оболочки, а в парообразном состоянии — через легкие. Скорость всасывания элементарного Й. из желудочно-кишечного тракта во многом зависит от качественного состава пищи. Содержащиеся в ней белки и жиры связывают элементарный Й. и замедляют его всасывание в кишечнике.
В значительных количествах Й. накапливается в органах осуществляющих его выделение из организма. При сифилисе и туберкулезе Й. накапливается также в гуммах и туберкулезных очагах, что, возможно, связано с высоким содержанием в них липидов.
Из организма Й. выводится главным образом почками (до 70—80% от введенного количества) и частично слюнными, молочными, потовыми, железами слизистой оболочки желудка.
Иод токсичен. При хронической интоксикации парами Й. или его соединениями наблюдаются слезотечение, насморк, кашель, слюнотечение, тошнота, рвота, головная боль, появляется угревая сыпь (йодизм). При попадании на кожу Й. может вызывать дерматиты. В тяжелых случаях возможно развитие специфического поражения кожи — йододермы. При отравлениях элементарным Й. язык и слизистая оболочка ротовой полости становятся бурыми, выдыхаемый воздух имеет специфический запах Й., ощущается жжение во рту и в верхних отделах желудочно-кишечного тракта, отмечаются слюнотечение, головная боль, отек гортани, носовые кровотечения, сыпь, морфологически похожая на крапивницу, пятнистую эритему и т. п., альбуминурия, гемоглобинурия.
Признаки острого отравления Й. в очень тяжелых случаях дополняются анурией, угнетением ц.н.с. отеком легких. Рвотные массы после приема элементарного Й. внутрь имеют коричневую или голубую (при наличии в желудочном содержимом крахмала) окраску. После отравлений Й. в течение долгого времени у пострадавшего отмечают слабость, угнетение системы иммунитета.
При оказании первой помощи больного нужно перенести на свежий воздух, согреть и обеспечить ему полный покой. Необходимо провести немедленную ингаляцию кислорода и 5% раствора натрия тиосульфата, внутривенно ввести 30—50 мл 10—20% раствора натрия тиосульфата. Внутрь назначают обильное питье мучного отвара, жидкого крахмального клейстера, водной суспензии активированного угля, молока (но не при отравлении йодоформом!), слизистых отваров, 5% раствора натрия тиосульфата (2—4 стакана), щелочных минеральных вод. Показано полоскание рта, горла и носа 2% раствором натрия бикарбоната; промывание желудка 1—3% раствором натрия тиосульфата, который переводит элементарный Й. в менее токсичный йодид натрия. При отравлениях любыми препаратами Й. применяют также солевые слабительные и средства симптоматической терапии.
Предельно допустимая концентрация паров йода и его соединений в воздухе рабочей зоны составляет 1 мг/м3.
Для качественного обнаружения Й. к исследуемому материалу приливают крахмальный клейстер и 1—2 капли хлорной воды; в присутствии Й. появляется синее окрашивание, исчезающее при нагревании и снова появляющееся при охлаждении. Выявить Й. можно также, прилив в пробирку с исследуемым материалом бензол, бензин или хлороформ с последующим добавлением хлорной воды. При встряхивании пробирки выделяющийся Й. переходит в слой растворителя, окрашивая его в характерный для Й. сине-фиолетовый цвет.
Количественное определение Й. производят титрованием испытуемого раствора азотнокислым серебром в присутствии индикатора или титрованием такого раствора в кислой среде тиосульфатом натрия в присутствии крахмального клейстера (см. Титриметрический анализ).
Препараты йода. В медицинской практике применяют препараты, содержащие элементарный йод, — раствор йода спиртовой, раствор Люголя (см. Антисептические средства), препараты, способные освобождать элементарный йод — йодинол, йодоформ, кальцийодид; препараты, диссоциирующие с образованием ионов йода (йодиды), — калия йодид и натрия йодид; препараты, содержащие прочно связанный йод, — йодолипол, билитраст и другие рентгеноконтрастные вещества; радиоактивные препараты йода.
Элементарный Й. обладает выраженными противомикробными свойствами. По характеру противомикробного действия Й. идентичен другим галогенам (хлору, брому), но вследствие меньшей летучести действует более продолжительно. Препараты, способные освобождать элементарный Й. (йодоформ и др.), оказывают противомикробное действие только при контакте с тканями и микроорганизмами, вызывающими восстановление связанного Й. до элементарного. В отличие от элементарного Й. йодиды практически не активны в отношении бактериальной флоры.
Для препаратов элементарного Й. характерно выраженное местнораздражающее действие на ткани. В высоких концентрациях эти препараты вызывают прижигающий эффект. Местное действие элементарного Й. обусловлено его способностью осаждать тканевые белки. Препараты, отщепляющие элементарный Й., оказывают значительно менее выраженное раздражающее действие, а йодиды обладают местнораздражающими свойствами только в очень высоких концентрациях.
Характер резорбтивного действия препаратов элементарного Й. и йодидов одинаков. Наиболее выраженное влияние при резорбтивном действии препараты Й. оказывают на функции щитовидной железы. В малых дозах (препарат «микройод») препараты Й. тормозят функцию щитовидной железы (см. Антитиреоидные средства), а в больших дозах стимулируют.
Влияние препаратов Й. на обмен веществ проявляется усилением процессов диссимиляции. При атеросклерозе они вызывают некоторое снижение концентрации холестерина и β-липопротеинов (см. Липопротеины) в крови; кроме того, повышают фибринолитическую и липопротеиназную активность сыворотки крови и замедляют скорость свертывания крови.
Накапливаясь в сифилитических гуммах, Й. способствует их размягчению и рассасыванию. Однако накопление Й. в туберкулезных очагах приводит к усилению в них воспалительного процесса. Выделение Й. экскреторными железами сопровождается раздражением железистой ткани и усилением секреции, поэтому препараты Й. (в малых дозах) обладают отхаркивающим действием и стимулируют лактацию. Однако в больших дозах они могут вызывать угнетение лактации.
Препараты Й. используют для наружного и внутреннего применения. Наружно назначают главным образом препараты элементарного Й. в качестве раздражающих и отвлекающих средств. Кроме того, эти препараты и препараты, отщепляющие элементарный Й., применяют в качестве антисептических средств.
Внутрь препараты Й. назначают при гипертиреозе, эндемическом зобе, третичном сифилисе, атеросклерозе, хронических интоксикациях ртутью и свинцом; в качестве отхаркивающих средств внутрь используют йодиды.
Противопоказаниями для внутреннего и парентерального применения препаратов Й. являются туберкулез легких, заболевания почек, геморрагический диатез, беременность, некоторые кожные заболевания (пиодермия, фурункулез) и повышенная чувствительность к йоду.
Калия йодид (kalii iodidum; синоним: калий йодистый, Kalium iodatum) представляет собой бесцветные или белые кубические кристаллы либо белый мелкокристаллический порошок без запаха, солено-горького вкуса. Растворим в воде (1:0,75), спирте (1:12) и глицерине (1:2,5).
Применяют для лечения и профилактики эндемического зоба, при гипертиреозе, сифилисе, глазных заболеваниях (катаракта и др.), актиномикозе легких, кандидозе, бронхиальной астме и в качестве отхаркивающего средства. Препарат назначают внутрь (в растворах и микстурах) из расчета по 0,3—1 г на прием, 3—4 раза в день после еды; при третичном сифилисе — в виде 3—4%. раствора по 1 столовой ложке 3 раза в день после еды. При актиномикозе легких применяют 10—20% растворы препарата по 1 столовой ложке 4 раза в день. Внутривенное введение растворов калия йодида противопоказано в связи с угнетающим действием ионов калия на сердце.
Формы выпуска: порошок: таблетки, содержащие по 0,5 г калия йодида и по 0,005 г калия карбоната. Хранение: в хорошо укупоренных банках оранжевого стекла.
Калия йодид выпускается также в виде специальных таблеток «Антиструмин», применяемых для профилактики эндемического зоба. Таблетки содержат по 0,001 г калия йодида.
Кальцийодин (Calciiodinum; синоним: кальция йодбегенат, сайодин) представляет собой смесь кальциевых солей йодбегеновой кислоты и других йодированных жирных кислот. Он имеет вид крупного желтоватого, жирного на ощупь порошка без запаха или со слабым запахом жирных кислот. Практически не растворим в воде, очень мало растворим в спирте и эфире, легко растворим в теплом безводном хлороформе. Содержит не менее 24% йода и 4% кальция.
Переносится лучше неорганических препаратов Й.: не раздражает слизистую оболочку желудка и кишечника, практически не вызывает явлений йодизма.
Применяют при атеросклерозе, нейросифилисе, бронхиальной астме, хроническом бронхите и других хронических заболеваниях, при которых показано лечение препаратами Й. Назначают внутрь по 0,5 г 2—3 раза в день после еды, таблетку следует хорошо раскрошить. Лечение проводят повторными курсами длительностью по 2—3 нед. с двухнедельными перерывами между отдельными курсами.
Форма выпуска: таблетки по 0,5 г. Хранение: в хорошо укупоренных банках темного стекла.
Натрия йодид (Natrii iodidum: синоним: натрий йодистый, Natrium iodatum) представляет собой белый кристаллический порошок без запаха, соленого вкуса. На воздухе сыреет и разлагается с выделением Й. Растворим в воде (1:0,6), спирте (1:3) и глицерине (1:2). По свойствам и показаниям к применению соответствует йодиду калия.
Назначают внутрь по 0,3—1 г 3—4 раза в день. В отличие от калия йодида препарат можно вводить внутривенно. При необходимости в вену вводят 10% раствор натрия йодида по 5—10 мл через 1—2 дня. Всего на курс лечения назначают 8—12 вливаний.
Форма выпуска: порошок. Хранение: в хорошо укупоренных банках оранжевого стекла, в сухом месте.
Натрия йодид и калия йодид входят в состав противоастматической микстуры по прописи Траскова (Mixtura antiasthmatica Trascovi).
Раствор йода спиртовой 5% (Solutio lodi spirituosa 5%, синоним: настойка йодная 5%, Tinctura lodi 5%, список Б) — прозрачная жидкость красно-бурого цвета с характерным запахом. Содержит йода 50 г, калия йодида 20 г, воды и 95% спирта поровну до 1 л.
Применяют наружно в качестве антисептического средства, например для обработки операционного поля и рук хирурга, при туалете и хирургической обработке ран, а также как раздражающее и отвлекающее средство. Внутрь принимают для профилактики и лечения атеросклероза, а также при лечении сифилиса. Для профилактики атеросклероза назначают по 1—10 капель 1—2 раза в день курсами по 30 дней 2—3 раза в год, для лечения атеросклероза — по 10—12 капель 3 раза в день, сифилиса — от 5 до 50 капель 2—3 раза в день. Препарат принимают в молоке после еды.
Детям в возрасте старше 5 лет можно давать по 3—6 капель 2—3 раза в день (по показаниям). Детям до 5 лет препарат не назначают.
Высшие дозы для взрослых внутрь: разовая — 20 капель, суточная — 60 капель.
Формы выпуска: в склянках оранжевого стекла по 10, 15 и 25 мл: в ампулах по 1 мл. Хранение: в защищенном от света месте.
Раствор йода спиртовой 10% (Solutio lodi spirituosa 10%, синоним: настойка йодная 10%, Tinctura lodi 10%, список Б) — жидкость красно-бурого цвета с характерным запахом. Содержит йода 100 г, 95% спирта до 1 л. При прибавлении к препарату воды выпадает мелкокристаллический осадок йода.
По свойствам, показаниям к применению (за исключением лечения сифилиса) и дозировке соответствует 5% спиртовому раствору йода. Детям внутрь препарат не назначают.
Высшие дозы для взрослых внутрь: разовая — 10 капель, суточная — 30 капель.
Форма выпуска: в склянках оранжевого стекла по 10, 15 и 25 мл. Хранение: в защищенном от света месте. Препарат готовят на непродолжительный срок (до 1 мес.) и отпускают только по специальным требованиям.
Библиогр.. Зилва Дж.Ф. и Пэннелл П.Р. Клиническая химия в диагностике и лечении, пер с англ., с. 186, M., 1988; Монач В.О. Йод и проблемы жизни, Л., 1974, библиогр.
II
(lodum, I)
химический элемент VII группы периодической системы элементов Д.И. Менделеева, ат. номер 53, ат. масса 126,9045; относится к галогенам; недостаток Й. в организме приводит к нарушению деятельности щитовидной железы.
Источник: Медицинская энциклопедия на Gufo.megufo.me
Йод и его характеристики
Общая характеристика йода
Йод относится к редким (рассеянным) элементам, однако в природе его все-таки можно встретить в свободном состоянии в виде минерала (термальные источники вулкана Везувия). Значительное количество йода содержится в морской воде в виде солей йодидов или в земной коре в составе нефтяных буровых вод.
В виде простого вещества йод представляет собой кристаллы черно-серого (темно-фиолетового) цвета (рис. 1) с металлическим блеском и резким запахом. Пары йода, также, как и его растворы в органических растворителях, окрашены в фиолетовый цвет.

Рис. 1. Йод. Внешний вид.
Атомная и молекулярная масса йода
Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного йода равна 126,9044 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы.
Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Известно, что молекула йода двухатомна – I2. Относительная молекулярная масса молекулы йода будет равна:
Mr(I2) = 126,9044 × 2 ≈ 254.
Изотопы йода
Известно, что в природе йод может находиться в виде единственного стабильного изотопа 127I. Массовое число равно 127, ядро атома изотопа содержит пятьдесят три протона и семьдесят четыре нейтрона.
Существуют искусственные нестабильные изотопы йода с массовыми числами от 108-ми до 144-х, а также семнадцать изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 129I с периодом полураспада равным 1,57×107 лет.
Ионы йода
На внешнем энергетическом уровне атома йода имеется семь электронов, которые являются валентными:
1s22s22p63s23p63d104s24p64d105s25р 5.
В результате химического взаимодействия йод отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион либо принимает электроны от другого атома, т.е. является их акцептором и превращается в отрицательно заряженный ион:
I0 -1e → I+;
I0 -3e → I3+;
I0 -5e → I5+;
I0 -7e → I7+;
I0 +1e → I—.
Молекула и атом йода
В свободном состоянии йод существует в виде двухатомных молекул I2. Приведем некоторые свойства, характеризующие атом и молекулу йода:
|
Энергия ионизации атома, эВ |
10,45 |
|
Относительная электроотрицательность |
2,66 |
|
Радиус атома, нм |
0,136 |
Примеры решения задач
ru.solverbook.com
Йод, Вступление | |
| Символ | I |
| Латинское название | Iodine |
| Тип вещества | простой химический элемент |
| Первооткрыватель | Б. Куртуа |
| Год открытия | 1811 |
Основные параметры йода по таблице Менделеева | |
| Атомный номер Z | 53 |
| Атомная масса | 126.90447 |
| Группа | 17 |
| Период | 5 |
| Принадлежность к группе | галогены |
Термодинамические свойства йода | |
| Агрегатное состояние при нормальных условиях | твердое тело |
| Точка плавления по Кельвину | 386.85 (Кельвин) |
| Точка плавления по Цельсию | 113.7 (°C) |
| Точка кипения по Кельвину | 457.45 (Кельвин) |
| Точка кипения по Цельсию | 184.3 (°C) |
Электрические свойства йода | |
| Тип электрической проводимости | диэлектрик |
Магнитные свойства йода | |
| Тип магнитной проницаемости | диамагнетик |
Свойства атома йода | |
| Конфигурация электронного облака | 1s2 | 2s22p6 | 3s23p6 | 3d104s24p64d105s25p5 |
| Радиус атома | 115 · 10 − 12 (Метр) |
Химические свойства йода | |
| Валентность | 7 |
Распространенность йода | |
| Вселенная состоит из йода на | 1×10-7% |
| Мировой океан состоит из йода на | 6×10-6% |
| Человеческое тело состоит из йода на | 0.00002% |
Вселенная | |
| Вселенная состоит из йода на | 1×10-7% |
www.fxyz.ru
Йод — это… Что такое Йод?
| Ио́д / Iodum (I) | |
|---|---|
| Атомный номер | 53 |
| Внешний вид простого вещества | |
| Свойства атома | |
| Атомная масса (молярная масса) | 126,90447 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 1 008,3 (10,45) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p5 |
| Химические свойства | |
| Ковалентный радиус | 133 пм |
| Радиус иона | (+7e) 50 (-1e) 220 пм |
| Электроотрицательность (по Полингу) | 2,66 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,93 г/см³ |
| Удельная теплоёмкость | 0,427 (I-I) Дж/(K·моль) |
| Теплопроводность | (0,45) Вт/(м·K) |
| Температура плавления | 386,7 K |
| Теплота плавления | 15,52 (I-I) кДж/моль |
| Температура кипения | 457,5 K |
| Теплота испарения | 41,95 (I-I) кДж/моль |
| Молярный объём | 25,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | орторомбическая |
| Период решётки | 7,720 Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| I | 53 |
| 126,90447 | |
| 5s25p5 | |
| Иод | |
Иод, йод (новолат. iodum от др.-греч. ἰοειδής, iodes — фиолетовый) — 53 элемент периодической системы элементов.
В медицине и биологии данное вещество обычно называют йодом (например «раствор йода»), в таблице Менделеева и химической литературе употребляется название иод.
История
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент.
Символ элемента, J был заменен на I относительно недавно, в 50-х годах XX века.
Нахождение в природе
Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия). Запасы природных иодидов оценваются в 15 млн тонн, 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода, например, чилийская Atacama Minerals производит свыше 720 тонн иода в год.
Физические свойства
Пары имеют характерный фиолетовый цвет, так же, как и растворы в неполярных органических растворителях, например в бензоле — в отличие от бурого раствора в полярном спирте. Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании при атмосферном давлении он сублимируется (возгоняется), превращаясь в пары фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки иода от нелетучих примесей.
Химические свойства
Иод образует ряд кислот: иодоводород (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Hg + I2 = HgI2
- I2 + H2 = 2НI
- I2 + H2S = S + 2НI
- При растворении в воде иод частично реагирует с ней:
- I2 + H2O = HI + HIO
Применение
Медицина
5%-ный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь при дефиците йода в организме. Продукты присоединения йода к крахмалу, другим ВМС («Синий йод» — Йодинол, Йокс, Бетадин) являются более мягкими антисептиками.
Широко используется в альтернативной (неофициальной) медицине, однако его использование без назначения врача в основном мало обосновано, и нередко сопровождается различными рекламными заявлениями.
Производство аккумуляторов
Иод используется в качестве положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Лазерный термоядерный синтез
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза и промышленность).
Радиоэлектронная промышленность
В последние годы резко повысился спрос на иод со стороны производителей жидкокристаллических дисплеев.
Динамика потребления иода
Мировое потребление иода в 2005 составило 25,5 тыс. тонн.
Важность для человека
Недостаток йода приводит к заболеваниям щитовидной железы
Биологическая роль
Иод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1 % иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
У животных и человека иод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12-20 мг иода, суточная потребность в иоде составляет около 0,2 мг (200 мкг). Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом иода, с профилактической целью добавляют иодид калия, иодид натрия или иодат калия (иодированная соль).
См. также
Ссылки
Wikimedia Foundation. 2010.
dic.academic.ru
